HIDROCARBUROS
Son los compuestos orgánicos más simples y están formados únicamente por carbono e hidrógeno. Como regla general son no polares.
¿Dónde podemos encontrarlos? El petróleo está compuesto por hidrocarburos, las distintas fracciones de la destilación primaria corresponden a hidrocarburos de distinto número de átomos de carbono. En algunas etápas de la refinación se obtienen hidrocarburos más complejos a partir de los simples.
Los distintos tipos de hidrocarbuos que existen se deben a la posibilidad del átomo de carbono de formar distintos tipos de enlaces:
- enlaces simples [hibridización sp3, disposición tetraédrica]
- enlaces dobles [hibridización sp2, disposición
triangular]
- enlaces triples [hibridización sp, disposición lineal]
En la siguiente tabla se indican los prefijos correspondientes para los distintos números de átomos de carbono presentes en la molécula. En el cuadro se ejemplifican los nombres de algunas ramificaciones o grupos alquilo (que se usaran más adelante).
*ALCANOS: cuando en la molécula solo hay enlaces simples.
fórmula molecular general: (CnH2n+2)
PREFIJO + ANO. Ej. Pentano

A los átomos de carbono de los alcanos se los puede clasificar en:
- Carbono primario: carbono unido a un
solo átomo de carbono (rojo).
- Carbono secundario: carbono unido a dos
átomos de carbono (verde).
- Carbono terciario: carbono unido a tres
átomos de carbono (naranja).
- Carbono cuaternario: carbono unido a cuatro átomos de carbono (azul).
*
ALQUENOS: cuando en la molécula hay por lo menos un enlace doble.
fórmula molecular general: (C
nH
2n)
(posición
del doble enlace)-PREFIJO + ENO. Ej. 2-penteno
* ALQUINOS: cuando en la molécula hay por lo menos un enlace triple.
fórmula molecular general: (CnH2n-2)
(posición
del triple enlace)-PREFIJO + INO. Ej. 2-pentino
Por otro lado, los átomos de carbono pueden combinarse formando cadenas
abiertas (hidrocarburos acíclicos o lineales, como los vistos recién) o cadenas cerradas (HIDROCARBUROS CICLICOS).
A estos últimos se le antepone el prefijo ciclo-
al nombre del hidrocarburo correspondiente.
También existen HIDROCARBUROS AROMÁTICOS. El más sencillo es el benceno (6 átomos de carbono y 6 de
hidrógeno) con estructura cíclica y tres enlaces dobles con posiciones
alternadas no definidas.
 |
| compuestos aromáticos (dibujo en el plano) |
 |
| compuestos aromáticos (estructura 3D) |
La estructura del
benceno es plana y simétrica, con ángulos de enlace de 120° y con enlaces C-C de igual
longitud. Los compuestos aromáticos son muy estables.
Los COMPUESTOS HALOGENADOS son derivados de los hidrocarburos en los
cuales uno o más átomos de hidrógeno han sido reemplazados por halógenos.
REGLAS DE NOMENCLATURA
1-Se identifica la
cadena carbonada más larga (azul) y se la nombra. Si el hidrocarburo contiene dobles y triples
enlaces, entonces se busca la cadena más larga que los contenga. Todo lo que
quede por fuera de la cadena principal son ramificaciones (rojo).
2-Se numeran los átomos
de carbono de la cadena principal. Si los enlaces son simples, se comienza por
el extremo más próximo a una ramificación. Si hay dobles o triples enlaces, se
numera de tal forma que ellos contengan el menor número posible (una vez definido el orden de los números no se vuelve a modificar).
3-Se nombran las ramificaciones como radical alquilo. y se indica su ubicación en la cadena lateral (el número se escribe delante de la cramificación separado por un guión). Si existe más
de una ramificación del mismo tipo, se añade un prefijo para indicar la
cantidad (di, tri, tetra, etc).
4- Se construye el nombre: delante del nombre de la cadena principal se incorporan las ramificaciones (sin la “o” de la terminación –ilo) ordenadas alfabeticamente.
Hidrocarburos aromáticos: se
tiene en cuenta el radical o sustituyente unido al anillo aromático. La
posición se indica mediante números. Si solo hay dos sustituyentes se pueden
usar prefijos orto- (o) [posiciones 1 y2], meta- (m) [posiciones 1 y 3], para-
(p) [posiciones 1,4].
Compuestos
halogenados: se trata al halógeno como un sustituyente más. También pueden
nombrarse como halogenuros de alquilo.
CH3-CH2-CH2-Cl
1-cloropropano
(cloruro de propilo)
COMPUESTOS OXIGENADOS
Dentro de este nombre se encuentran diferentes compuestos formados por carbono, hidrógeno y oxígeno. La incorporación del oxígeno a la molécula hace que esta se vuelva polar, además si el oxígeno está unido a un átomo de hidrógeno ese tipo de compuestos va a presentar interacción puente de hidrógeno entre sus moléculas.
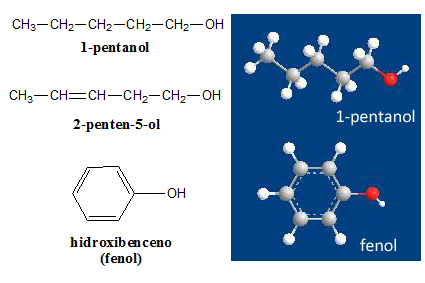
ALCOHOLES. El grupo
funcional de los alcoholes se denomina hidroxilo (-OH) y se une a la cadena carbonada o a un compuesto aromático. Presentan propiedades físicas y químicas
características. ¿Qué tipo de interacciones presenta? Entre las moléculas de los alcoholes se observan interacciones de London, dipolo-dipolo y puente de hidrógeno. Es por esto que si comparamos a los alcoholes con los alcanos de similar masa molar, vemos que tienen puntos de ebullición mucho mayores (ver propiedades físicas).
Para nombrarlos se puede usar el prefijo hidroxi- (cuando se los trata como sustituyente) o la terminación
–ol en el alcano correspondiente (cuando están formando parte de
la cadena principal).
Teniendo en cuenta si están unidos a un carbono primario, secundario o
terciario los alcoholes se pueden
clasificarse en alcoholes primarios (unido a un carbono primario), alcoholes secundarios (unidos a un carbono secundario) o alcoholes
terciarios (unidos a un carbono terciario).
Un alcohol muy conocido.... el etanol (C2H6O). Se usa como desinfectante, para la preparación de bebidas alcohólicas y como biocombustible!!!!
ÉTERES. El grupo funcional de los éteres consiste en un oxígeno unido a dos grupos carbono (-O-). Son moléculas polares. Los éteres de pocos átomos de carbono son compuestos volátiles con olor característico. Se los puede nombrar
de dos formas:
1) anteponiendo la palabra éter
a los grupos alquilo (ordenados alfabéticamente y el último con la terminación -ico).
2) ordenando
los grupos alquilo alfabéticamente, seguido de la palabra éter.
ALDEHÍDOS Y CETONAS. La caracteristica común de los aldehídos y cetonas es el grupo funcional carbonilo (C=O). En los aldehídos este grupo se encuentra al final de la cadena hidrocarbonada
y por lo tanto el carbono esta unido a un átomo de hidrógeno. En las cetonas el grupo carbonilo se encuentra en el interior de la cadena.
Son compuestos polares.
Para nombrarlos se reemplaza la terminación -o del hidrocarburo por –al
(aldehídos) y –ona (cetonas).
ÁCIDOS CARBOXÍLICOS. Los ácidos carboxílicos son compuestos orgánicos que presentan un hidrógeno ácido, esto les confiere una caracteristica común: son compuestos con propiedades ácido-base. Además la presencia del hidroxilo hace que puedan formar interacción puente de hidrógeno entre sus moléculas.
Para nombrarlos se
agrega la terminación –ico al nombre
del alcano y se antepone la palabra ácido.
El ácido fórmico es el ácido que inyectan las hormigas al morder. El ácido acético se usa en la cocina, es el vinagre.
ÉSTERES. Grupo funcional éster.
Son derivados de los ácidos carboxílicos más un alcohol. Se nombran
identificando primero al ácido carboxílico (se elimina la palabra ácido y se sustituye –ico por –ato) y denominando luego al grupo alquilo unido al oxígeno.
Muchos ésteres tienen olores característicos y es por eso que a muchos se los utiliza como fragancias y saborizantes.
COMPUESTOS NITROGENADOS
Dentro de este nombre se encuentran diferentes compuestos formados por
carbono, hidrógeno y nitrógeno. La incorporación del nitrógeno hace que estas moléculas sean polares, además si el nitrógeno está unido a un
átomo de hidrógeno ese tipo de compuestos va a presentar interacción
puente de hidrógeno entre sus moléculas.
AMINAS. Las aminas presentan el grupo
funcional más sencillo entre un nitrógeno y uno o más átomos de carbonos, denominado amino. Se las puede considerar como derivados del amoníaco (NH
3)
en el cual uno, dos o tres hidrógenos se remplazan por grupos alquilo (-R) o arilo (-Ph).
La estructura que van a tener las aminas va a ser piramidal: el nitrógeno va a formar tres enlaces simples con átomos de carbono o hidrógeno, quedando un par de electrones en un orbital vacio.
Este par de electrones sin compartir va a darle a las aminas propiedades ácido-base: las aminas son compuestos básicos.
Al igual que los carbonos y alcoholes se las puede clasificar en
aminas primarias (cuando solo se unen a un grupo -R),
aminas secundarias (se unen a dos grupos -R) y
aminas terciarias (tres grupos –R). Las aminas primarias y secundarias van a poder formar puente de hidrógeno. Se las puede nombrar como alquilaminas (radical alquilo con la terminación
-amina) o como alcanaminas (alcano con la terminación
-amina).
AMIDAS.Grupo
funcional amido. Son derivados de ácidos carboxílicos y amoníaco (o aminas). Se nombran eliminando
la palabra
ácido y se reemplaza la
terminación
–ico por
–amida.
Los nailons son fibras de poliamidas (muchas aminas juntas unidas formando una cadena).
NOMENCLATURA DE COMPUESTOS POLIFUNCIONALES
Para establecer el nombre de una molécula con varios grupos funcionales se sigue la siguiente regla:
1- Indicar el grupo funcional principal (de mayor prioridad) que le va a dar el nombre base a la cadena.
2- Identificar la cadena hidrocarbonada más larga que contenga a dicho grupo (cadena principal), enumerarla de forma que el grupo funcional principal tenga el número menor.
3- Identificar los sustituyentes que presenta la cadena principal y nombrarlos.
4- Asignar los números que indican la ubicación de los sustituyentes y ordenarlos alfabéticamente delante del nombre de la cadena principal.